研究者紹介
ライフサイエンス/計測・解析グループ
[教授] 米倉 功治 [教授] 和田 健彦 [教授] 原田 昌彦 [教授] 権田 幸祐 [教授] 南後恵理子 [准教授] 濵口 祐

東北大学 多元物質科学研究所
教授
米倉 功治
クライオ電子顕微鏡解析
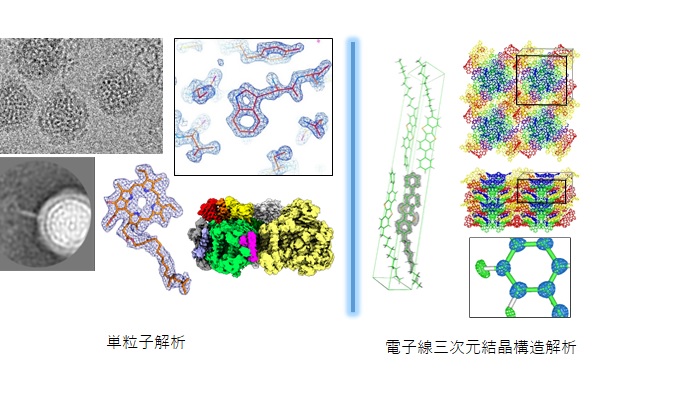
クライオEM解析
最先端のクライオ電子顕微鏡(EM)システムを運用、高度化し、分子像からの単粒子解析と微小結晶回折からの結晶解析により、生体超分子複合体、膜蛋白質、アミロイド繊維、薬剤候補物質、機能性材料分子など多岐にわたる試料の構造を高分解能かつ高精度で明らかにします。さらに、AIを利用した自動・遠隔測定や解析技術の開発を進めていきます。
代表的な論文
Hydrogen properties and charges in a sub-1.2 Å cryo-EM structure by the cold field emission beam
Maki-Yonekura S., Kawakami K., Hamaguchi T., Takaba K., Yonekura K.; bioRxiv, doi: /10.1101/2021.12.21.473430v1
クライオEMの単粒子解析で、水素原子の結合タイプの同定と電荷情報が取得できる高精度解析を実現した。
もっと見る
Hydrogen properties in an organic molecule revealed by XFEL and electron crystallography
Takaba K., Maki-Yonekura S., Inoue I., Tono K., Hamaguchi T., Kawakami K., Naitow H., Ishikawa T., Yabashi M., Yonekura K.* (2022); ChemRxiv, doi: 10.26434/chemrxiv-2021-jvbfl
電子線とXFELを組み合わせた有機低・中分子の微小結晶解析を確立した。
Core and rod structures of a thermophilic cyanobacterial light-harvesting phycobilisome
Kawakami K.*, Hamaguchi H., Hirose Y., Kosumi D., Miyata M., Kamiya N., Yonekura K.* (2022); Nat. Commun. In press
光捕集を行う巨大蛋白質複合体の単粒子解析から、機能メカニズムを明らかにした。

東北大学 多元物質科学研究所
教授
和田 健彦
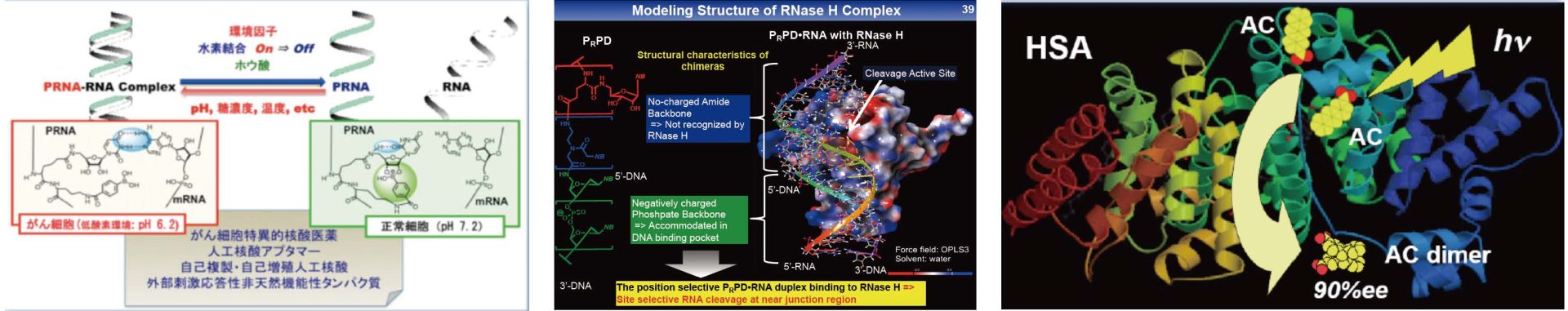
1. 触媒的標的RNA切断機能付与型核酸医薬(キメラ人工核酸)開発:COVID-19治療薬開発を目指して
2. 細胞内環境応答型核酸医薬(PRNA)開発:癌細胞選択的核酸医薬開発を目指して
3. タンパク質を反応場して活用した超分子不斉光反応系の構築:環境調和型不斉光反応系開発を目指して
4. 標的細胞選択的薬物運搬システムの構築:MMPを活用した転位制癌選択的DDSの開発を目指して
和田研究室では、DNA/RNAやタンパク質等生体高分子の次世代インテリジェント型ナノバイオ機能材料への応用を目指し研究を推進しています。
具体的には外部刺激に応答して機能発現のon-off制御が可能な人工核酸創製に取組み、癌細胞や脳梗塞周辺細胞等でのみ選択的に薬効発現する細胞内環境応答型核酸医薬開発や、極少量の核酸医薬でも優れた薬効を発現可能な標的RNAの高効率触媒的切断機能付与型キメラ人工核酸の開発にも取組み、AMEDのCOVID-19治療薬開発プロジェクトにも採択され研究推進しています。また、タンパク質等生体高分子をキラルナノバイオリアクターとして活用し、光反応を組合わせた超分子不斉光反応系構築にも取組んでいます。

東北大学 大学院農学研究科
教授
原田 昌彦
ゲノム機能制御機構の解明と応用利用/食・農・生命科学領域における次世代放射光活用
実験モデル生物や培養細胞を用いて、遺伝子やゲノムの機能を制御する分子メカニズムについての研究を行い、そのメカニズムを利用して人為的に遺伝子や細胞機能を制御する方法の開発に取り組んでいます。また、食品や農畜水産物、さらにさまざまな生命現象に関する課題を、次世代放射光を利用して解明・利用することにも取り組んでいます。このような取り組みの推進を目的として、農学研究科附属放射光生命農学センター(A-Sync:Center for Agricultural and Life Sciences using Synchrotron Light)を立ち上げました。

代表的な論文
The auxin-inducible degron 2 (AID2) system enables controlled protein knockdown during embryogenesis and development in Caenorhabditis elegans
Negishi T, Kitagawa S, Horii N, Tanaka Y, Haruta N, Sugimoto A, Sawa H, Hayashi KI, Harata M*, Kanemaki MT*. (* corresponding authors); Genetics. 2022 Feb 4;220(2):iyab218. doi: 10.1093/genetics/iyab218. PMID: 34865044
動物発生におけるゲノム機能制御のメカニズムの解明のため、多細胞生物のモデル系である線虫を用いて、人為的に特定のタンパク質を分解するAID2システムを開発した。このシステムを用いて、DNAに結合して遺伝子機能を制御するヒストンバリアントH2A.Zが、多細胞生物の発生や分化に重要な機能を有することを明らかにした。
もっと見る
THz irradiation inhibits cell division by affecting actin dynamics
Yamazaki S, Ueno Y, Hosoki R, Saito T, Idehara T, Yamaguchi Y, Otani C, Ogawa Y, Harata M, Hoshina H.; PLoS One. 2021 Aug 2;16(8):e0248381. doi: 10.1371/journal.pone.0248381. eCollection 2021. PMID: 34339441
生きた状態の培養細胞にTHz光照射を行い、生細胞内のアクチン繊維の経時的観察を行うと共に、細胞増殖の様子を観察した。その結果、細胞質分裂時のアクチンフィラメント(contractile ring)の消失とそれに伴う細胞分裂がTHz光照射によって阻害されることを明らかにした。この結果は、生細胞内の水分子やタンパク質分子の動態にTHz光が摂動を与え、その結果、細胞機能変化が誘導されたことを示唆している。
The Actin-Family Protein Arp4 Is a Novel Suppressor for the Formation and Functions of Nuclear F-Actin
Yamazaki S, Gerhold C, Yamamoto K, Ueno Y, Grosse R, Miyamoto K, Harata M.; Cells. 2020 Mar 19;9(3):758. doi: 10.3390/cells9030758. PMID: 32204557
細胞の運動や分裂に重要な役割を果たすアクチン繊維は、細胞核においては遺伝子発現やDNA損傷修復に重要な役割を果たしている。しかし、細胞核内でアクチンの重合や脱重合がどのように制御されているかについては、ほとんど明らかにされていない。我々は、細胞核に局在しているアクチン関連タンパク質(Arp)の一つであるArp4が、細胞核内のアクチン重合を抑制していることを明らかにし、核内アクチン動態の人為的制御の可能性を示した。

東北大学 大学院医学系研究科
教授
権田 幸祐
ナノメディシンによる血管病変の解明と医療応用
我々は、がん、血栓症、糖尿病のモデルマウスを高分解能・高感度にてイメージングし、疾病組織中の血管病変の核心に迫り、新たな診断技術や薬剤開発に繋げることを目標にしています。これまでに、高輝度蛍光ナノ粒子や高X線吸収ナノ粒子を利用して光学顕微鏡やµX線CT装置で計測を行うことで、ナノテクノロジーの医学・医療応用(ナノメディシン)を実施してきました。ソフトマテリアル研究拠点では、これらの計測にクライオ電顕での観察を融合し、血管病変の解明と医療応用を促進するナノメディシンとして新たな技術へ発展させたいと考えています。
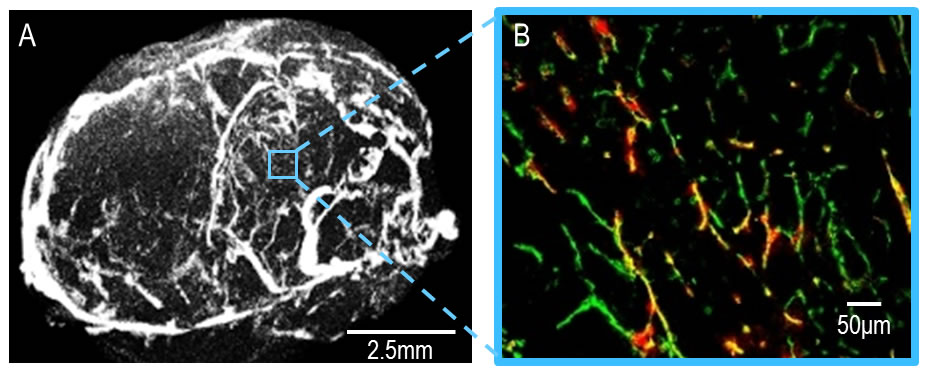
腫瘍血管の可視化
(A)はµX線CTを使い生体計測で可視化された腫瘍血管を示す。腫瘍内で還流している血管が白く写っている。
(B)は腫瘍組織を薄切した後、蛍光免疫染色した画像を示す。黄色は血流が豊富な血管を表しており、緑色は血流が乏しい血管を表している。
代表的な論文
In vivo nano-imaging of membrane dynamics in metastatic tumor cells using quantum dots
Gonda K⃰, Watanabe TM, Ohuchi N, Higuchi H.; Journal of Biological Chemistry 285:2750-2757 (2010).
マウス内でタンパク質1分子の動きを9nmで解析できる装置を開発し、がん転移を引き起こす細胞膜タンパク質に蛍光標識を行い、生体内でのがん転移の様子をリアルタイムで可視化した。その結果、 (1)がん細胞の形態の変化が、がん転移時に重要であること、(2)転移の進行に従い膜タンパク質の移動速度(拡散速度)が1,000倍以上変化し、速度増加が転移の活性化に重要であること、を初めて示した。
もっと見る
Quantitative diagnostic imaging of cancer tissues by using phosphor-integrated dots with ultra-high brightness
Gonda K⃰, Watanabe M, Tada H, Miyashita M, Takahashi-Aoyama Y, Kamei T, Ishida T, Usami S, Hirakawa H, Kakugawa Y, Hamanaka Y, Yoshida R, Okada H, Goda H, Negishi H, Takanashi K, Takahashi M, Ozaki Y, Yoshihara Y, Nakano Y, Ohuchi N.; Scientific Reports 7: 7509 (2017).
独自開発した超高輝度蛍光ナノ粒子と画像解析により、従来の方法に比べ300倍以上の検出感度でヒトがん組織のタンパク質量を高精度定量する方法を開発した。この方法を乳がん患者のがん組織診断に応用した結果、薬物療法の効果を治療前に精度よく診断予測することに成功した。本法は患者に適した抗がん剤を選択する際有効であり、プレシジョン・メディシンへの貢献が期待された。
The anti-angiogenic agent lenvatinib induces tumor vessel normalization and enhances radiosensitivity in hepatocellular tumors
Une N, Takano-Kasuya M, Kitamura N, Ohta M, Inose T, Kato C, Nishimura R, Tada H, Miyagi S, Ishida T, Unno M, Kamei T, Gonda K⃰.; Medical Oncology 38: 60 (2021).
独自開発した高X線吸収性血管造影ナノ粒子によるX線CTイメージングと蛍光イメージングの両者を併用することにより、異なる血管新生阻害剤(抗がん剤)が腫瘍血管の構造変化に与える影響の違いを可視化し数値解析を行った。その結果、薬物が誘導する「腫瘍血管の正常化」の程度に差異があることを明らかにし、この差異が薬物療法と放射線治療の併用効果にも大きく影響することを明らかにした。

東北大学 多元物質科学研究所 有機・生命科学研究部門
教授
南後恵理子
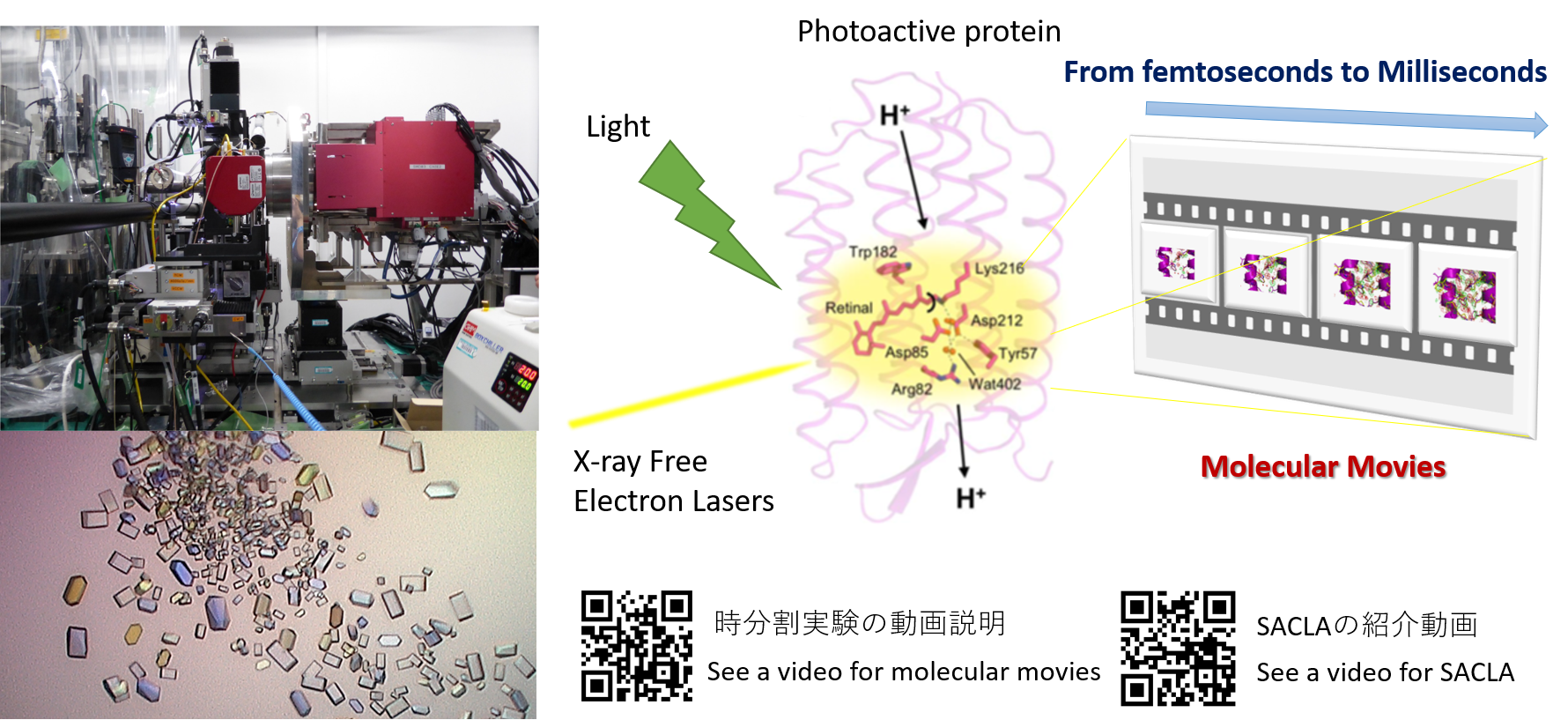
時分割結晶構造解析の技術開発
受容体、酵素などタンパク質の機構解析
動的構造情報に基づく合理的分子設計
細胞情報伝達、生体内触媒反応など、生命現象を支える重要な生体構成物質であるタンパク質の立体構造はその機能と深く関連しており、機能を発揮する際にどのような構造の変化を起こすのか興味が持たれてきました。当研究室では、X線自由電子レーザー、放射光などの量子ビームを用いて、タンパク質の中で実際に起こっている化学変化や構造変化を“動画”として可視化する技術開発を行い、光感受性タンパク質の反応機構やユニークな反応を触媒する酵素の反応機構解明に取り組んでいます。また、得られた精密な構造情報を基にタンパク質分子の合理的設計と新機能をもつ分子の創製を目指します。
代表的な論文
Mapping protein dynamics at high spatial resolution with temperature-jump X-ray crystallography
Wolff A.M., Nango E.*, Young I.D., Brewster A.S., Kubo M., Nomura T., Sugahara M., Owada S., Barad B.A., Ito K., Bhowmick A., Carbajo S., Hino T., Holton J.M., Im D., O’Riordan L. J., Tanaka,T., Tanaka R., Sierra R.G., Yumoto F., Tono K., Iwata S., Sauter N.K., Fraser J.S., ThompsonM.C. ; Nat. Chem. 15, 1549-1558 (2023).
もっと見る
Conformational alterations in unidirectional ion transport of a light-driven chloride pump revealed using X-ray free electron lasers
Hosaka T., Nomura T., Kubo M., Nakane T., Fangjia L., Sekine S.-i., Ito, T., Murayama K., Ihara K., Ehara H., Kashiwagi K., Katsura K., Akasaka R., Hisano T., Tanaka T., Tanaka R., Arima T., Yamashita A., Sugahara, M., Naitow H., Matsuura Y., Yoshizawa S., Tono K., Owada S., Nureki O., Kimura-Someya T., Iwata S., Nango E.*, Shirouzu M.*; PNAS 119, e2117433119 (2022).
A three-dimensional movie of structural changes in bacteriorhodopsin
Nango E., Royant A., Kubo M., Nakane T., Wickstrand C., Kimura T., Tanaka T., Tono K., Song C., Tanaka R., Arima T., Yamashita A., Kobayashi J., Hosaka T., Mizohata E., Nogly P., Sugahara M., Nam D., Nomura T., Shimamura T., Im D., Fujiwara T., Yamanaka Y., Jeon B., Nishizawa T., Oda K., Fukuda M., Andersson R., Bath P., Dods R., Davidsson J., Matsuoka S., Kawatake S., Murata M., Nureki O., Owada S., Kameshima T., Hatsui T., Joti Y., Schertler G., Yabashi M., Bondar A. N., Standfuss, J., Neutze R.*, Iwata, S.*; Science 354, 1552-1557 (2016).




