ニュース NEWS
[Press Release] 筋萎縮性側索硬化症(ALS)の発症機構の一端を解明 ータンパク質の高密度な凝縮構造が鍵ー
京都大学大学院理学研究科 関山直孝 助教、児玉高志 同研究員(研究当時、現:大阪大学蛋白質研研究所)、杤尾豪人 同教授、理化学研究所放射光科学研究センター 高場圭章 基礎科学特別研究員、眞木さおり 同研究員、米倉功治 グループディレクター(東北大学多元物質科学研究所 教授を併任)らの共同研究グループは、筋萎縮性側索硬化症(ALS: Amyotrophic lateral sclerosis)※1の発症に関わる機構として、T-cell intracellular antigen-1(TIA-1)のプリオン様ドメインに生じるアミノ酸変異が高密度な凝縮構造を形成することがその一因となっていることを解明しました。
細胞質に形成されるストレス顆粒(SGs)の主要な構成因子の一つであるTIA-1は、特定の立体構造を持たない天然変性タンパク質領域※2であるプリオン様ドメイン(PLD)を持ちます。TIA-1のPLDには、神経変性疾患の一種である筋萎縮性側索硬化症(ALS)に関するアミノ酸変異(ALS変異)が確認されていましたが、これらの変異がどのように病気を引き起こすのかはわかっていませんでした。本研究では、核磁気共鳴法(NMR: Nuclear magnetic resonance)※3や分子動力学シミュレーション※4、そして3次元電子線結晶構造解析※5を用いて、ALS変異が引き起こす微細な構造変化を明らかにしました。この成果は、TIA-1が形成する凝縮構造を標的としたALS治療薬の開発などに貢献することが期待されます。
本研究成果は、2022年9月16日(米国東部時間)に米国科学雑誌「Proceedings of the National Academy of Sciences of the United States of America」に公開されました。
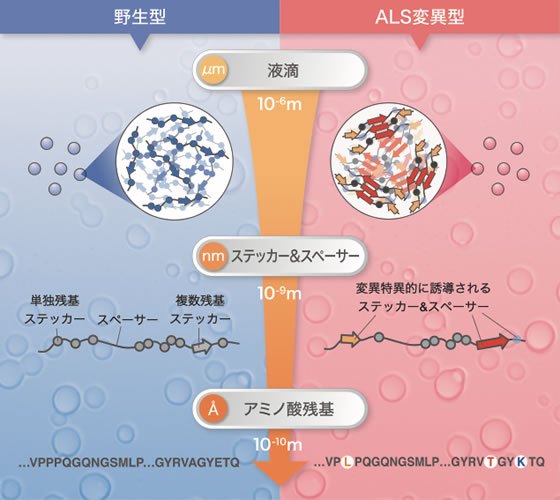
TIA-1の液滴形成は階層的なメカニズムで制御されており、ALS変異は周辺領域のステッカー&スペーサー骨格を変化させ高密度な凝縮構造を誘起していました。
1.背景
相分離とは、水に浮く油のように2つの物質が混ざり合わず2相に分かれてしまう現象のことですが、近年、この相分離現象が細胞内でも起こっていることが明らかとなってきました。液-液相分離(LLPS: Liquid-Liquid Phase Separation)と呼ばれるこの現象は、タンパク質が”液滴”の性質を有する凝縮体、いわゆる非膜型オルガネラ(MLOs: Membraneless organelles)を形成する生物学的事象のことです。LLPSはタンパク質の機能を時空間的に制御するメカニズムであると考えられており、多岐にわたる生理学的機能の理解に繋がることが期待されています。
細胞質に形成されるMLOsの一種にストレス顆粒(SGs)があります。SGsの主要な構成因子の一つであるT-cell intracellular antigen-1(TIA-1)は、特定の立体構造を持たない天然変性タンパク質領域であるプリオン様ドメイン(PLD: Prion-like domain)を持ちます。TIA-1のPLDは自己凝縮能を持つことから、LLPSを駆動する中心的な役割を担っていると考えられていました。加えて、家族性の筋萎縮性側索硬化症(ALS: Amyotrophic lateral sclerosis)やウェランダー遠位型ミオパチー(WDM: Welander distal myopathy)※6の遺伝子解析から、TIA-1のPLDにはこれら神経変性疾患に関わるアミノ酸変異が確認されていました。しかし、これらのアミノ酸変異がどのように病気を引き起こすのか、その分子メカニズムはわかっていませんでした。そこで本研究は、TIA-1のPLDの液滴形成能と疾患関連アミノ酸変異の関係を明らかにすることを目的としました。
2.研究手法・成果
本研究では初めに、TIA-1のアミノ酸配列の中で、液滴形成能を持つ最小領域の探索を行いました。その結果、温度依存的に凝縮と溶解を繰り返すsmall PLD(smPLD)領域を同定しました。smPLD液滴に対してALS変異が与える影響を生化学的手法により解析したところ、ALS変異であるP362LとA381Tは野生型に比べて液滴形成を促進することがわかりました。
我々は、これらALS変異の影響をさらに詳しく調べるために、構造学的手法を用いてTIA-1 PLD分子の動的な構造を解析しました。核磁気共鳴法(NMR: Nuclear magnetic resonance)による解析では、PLDの動的構造は、アミノ酸の物理化学的性質が5残基単位で協調することで決定されていることがわかりました。この結果は、たとえ1つのアミノ酸変異であっても、アミノ酸配列の並び方によって周囲への影響が異なることを示唆しています。
次に、分子動力学シミュレーションを用いて、野生型とP362Lの動的構造を比較したところ、P362Lでは変異箇所周辺にベータヘアピン構造を形成しやすいことがわかりました(図1A)。このような分子内ベータシート相互作用の増強は、P362L変異型がアミロイド線維を形成しやすい性質へ変化したことを示唆しています。
A381T変異に関しては、野生型とA381T変異箇所を含む2種類のペプチドの結晶を作成し、3次元電子線回折法を用いてこれらの結晶構造を原子レベルで明らかにしました。その結果、野生型およびA381T変異型の両ペプチドは逆平行ベータシート構造を形成することがわかりました。しかし、その階層構造には大きな違いがあり、野生型では三角形のハニカム構造を形成していたのに対し、A381T変異型ではベータシートが層状に積み重なった積層構造を形成していました(図1B)。A381T変異型が作る高密度な凝縮構造は、液滴から不可逆的なアミロイド線維が形成される要因になることを示唆しており、我々はこのような構造変化が病気の発症につながるのではないかと考えています。
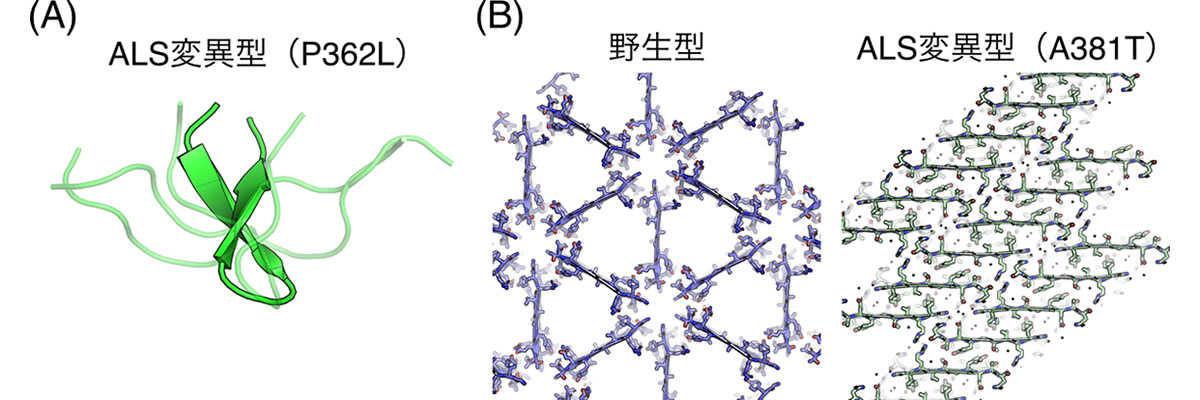
図1.(A)分子動力学シミュレーションによるP362Lの動的構造
(B)3次元結晶構造解析による野生型およびA381Tの結晶構造
3.波及効果、今後の予定
TIA-1はSGsの主要な構成要素であるだけでなく、多様な生理学的機能を持つことから、SGsの発見以来、約20年に渡って研究されてきました。本研究では、疾患関連アミノ酸変異がTIA-1の液滴形成能をどのように変えるかを原子レベルで解明し、TIA-1 PLD液滴内で働く分子間相互作用の特性を定量化した5アミノ酸モデルを提案しました。このモデルは、アミノ酸変異が凝縮体の特性に及ぼす影響を定量的に評価することができるため、天然変性タンパク質領域に生じる疾患関連アミノ酸変異と病気の発症メカニズムの関連を解明する可能性を秘めています。
4.研究プロジェクトについて
本研究は、日本学術研究振興会科学研究費補助金 基盤研究(C)「天然変性蛋白質による可逆的凝集機構の構造学的解明」19K06584、文部科学省科学研究費補助金 学術変革領域(B)「動的溶液環境が制御する生体内自己凝縮過程の統合的理解」22B308 計画研究「生化学的手法を用いた天然変性タンパク質の自己凝縮過程を制御する動的溶液環境の解明」22H05090、科学技術振興機構(JST)戦略的創造研究推進事業CREST「高速原子間力顕微鏡1分子計測のデータ同化による生体分子4次元構造解析法の開発」JPMJCR1762、科学技術振興機構(JST)未来社会創造事業探索加速型「微小結晶構造の自動・高精度電子線解析」JPMJMI20G5、日本医療研究開発機構(AMED)医療研究開発革新基盤創成事業(CiCLE)、の支援を受けて実施されました。また、文部科学省先端研究基盤共用促進事業(新たな共用システム導入支援プログラム)JPMXS0421700120で共用された機器を利用しました。本研究は、京都大学大学院理学研究科、理化学研究所放射光科学研究センター、医薬基盤・健康・栄養研究所(NIBIO)、MRC分子生物学研究所の国際共同研究として実施されました。
用語解説
※1. 筋萎縮性側索硬化症(ALS: Amyotrophic lateral sclerosis):運動を司る神経(運動ニューロン)が障害を受け、筋肉が動かせなくなる病気。ALSのうち約5%は家族歴を伴い、家族性ALSと呼ばれる。TIA-1のアミノ酸変異も家族性ALSの遺伝子解析から見つかっている(Mackenzie et al. 2017 Neuron)。
※2. 天然変性タンパク質領域:一般的なタンパク質はポリペプチド鎖が折り畳まれ特定の立体構造をとるが、天然変性タンパク質領域は特定の立体構造をとらず、ランダムコイル状の不規則な立体構造をとる。
※3. 核磁気共鳴法(NMR: Nuclear magnetic resonance):強い磁場中に置かれた原子核に電磁波を照射することで起こる核スピンの共鳴現象を利用し、タンパク質分子の構造や運動性を解析する手法。
※4. 分子動力学シミュレーション:タンパク質分子を構成する原子1つ1つに対して、古典力学におけるニュートンの運動方程式を解くことで、分子の立体構造の時間変化を解析する計算機シミュレーション手法。
※5. 3次元電子線結晶構造解析:電子顕微鏡を用い、結晶に電子線を当てることで電子線回折を起こし、構造情報を得る手法。電子顕微鏡を用いるため、微小な結晶(100 nm〜1 m程度)でも回折情報を得ることができる。
※6. ウェランダー遠位型ミオパチー(WDM: Welander distal myopathy):遺伝的な筋肉の病気(筋疾患)の一つで、体幹から遠い筋(遠位筋)、例えば足首を動かすような筋肉や指先を動かすような筋肉から障害される病気。
<研究者のコメント>
本研究は、天然変性タンパク質の可逆的な自己凝縮機構を解き明かすことを目的として始めました。当初は試料調製法や実験手法が確立しておらず手探りの状態でしたが、凝縮体の状態や分子の構造が徐々に明らかになっていく中で、対象に対する自分のイメージも明確になってきました。今後は、このイメージをさらに拡張していき、より普遍的な原理を解き明かして行きたいです。(関山直孝)
論文情報
“ALS mutations in the TIA-1 prion-like domain trigger highly condensed pathogenic structures”
(TIA-1プリオン様ドメインのALS変異は高密度な病原性構造を誘起する)
関山直孝、高場圭章、眞木さおり、赤木謙一、大谷寧子、今村香代、寺川剛、山下恵太郎、米倉功治、児玉高志、杤尾豪人
Proceedings of the National Academy of Sciences of the United States of America(PNAS)
DOI:10.1073/pnas.2122523119
※論文公開日を訂正しました。(令和4年10月3日)
関連リンク:
京都大学
理化学研究所
東北大学
生物分子機能計測研究分野(米倉功治研究室)
問い合わせ先
(研究に関すること)
関山 直孝(せきやま なおたか)
京都大学大学院理学研究科 助教
TEL:075-753-4217 FAX:075-753-4218
E-mail: sekiyama.naotaka.5x*kyoto-u.ac.jp(*を@に置き換えてください)
米倉 功治(よねくら こうじ)
東北大学多元物質科学研究所 教授
生物分子機能計測研究分野
TEL:022-217-5380
E-mail:koji.yonekura.a5 * tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
京都大学 総務部広報課国際広報室
TEL:075-753-5729 FAX:075-753-2094
E-mail: comms*mail2.adm.kyoto-u.ac.jp(*を@に置き換えてください)
理化学研究所 広報室 報道担当
E-mail: ex-press*riken.jp(*を@に置き換えてください)
東北大学多元物質科学研究所 広報情報室
TEL:022-217-5198
E-mail: press.tagen*grp.tohoku.ac.jp(*を@に置き換えてください)



