ニュース NEWS
[Press Release] クライオ電顕により電荷、水素原子、化学結合を可視化 -タンパク質の詳細な化学特性の理解から、創薬への貢献に期待-
理化学研究所(理研)放射光科学研究センター利用システム開発研究部門SACLAビームライン基盤グループイメージング開発チームの眞木さおり研究員、利用技術開拓研究部門生体機構研究グループの川上恵典研究員、米倉功治グループディレクター(東北大学多元物質科学研究所教授)、高場圭章基礎科学特別研究員、濵口祐研究員(研究当時)の研究チームは、クライオ電子顕微鏡[1]を用いた単粒子解析[2]から、タンパク質中のほとんどの水素原子の可視化と、電荷・化学結合に関わる情報の取得に成功しました。
本研究成果は、生理的な環境に近い水溶液中のタンパク質の機能を決定する詳細な構造特性が観察可能なことを示すもので、今後、タンパク質の化学的性質・機能の理解を深め、生命科学や医学、創薬に貢献すると期待できます。
タンパク質中の水素原子、電荷、化学結合の極性[3]は、構造の安定化に重要な役割を果たすとともに、酵素触媒作用、エネルギー伝達、基質や薬剤との結合など、さまざまな機能と性質に大きな影響を及ぼします。
今回、研究チームはアポフェリチンというタンパク質の溶液を凍結し、高性能クライオ電子顕微鏡を用いて撮影した分子像から、このタンパク質の詳細な構造を高い空間分解能[4]で明らかにしました。最も軽い原子である水素原子からの信号は弱く、可視化が難しいことが知られていますが、解析を工夫した結果、タンパク質の安定部位にあるほぼ全ての水素原子と、負に帯電したアミノ酸の電荷を可視化することに成功しました。また、得られた構造は、水素原子の結合距離からその化学結合の種類を判別できる精度を持つことも示しました。 本研究は、オンライン科学雑誌『Communications Chemistry』(5月31日付:日本時間5月31日)に掲載されます。
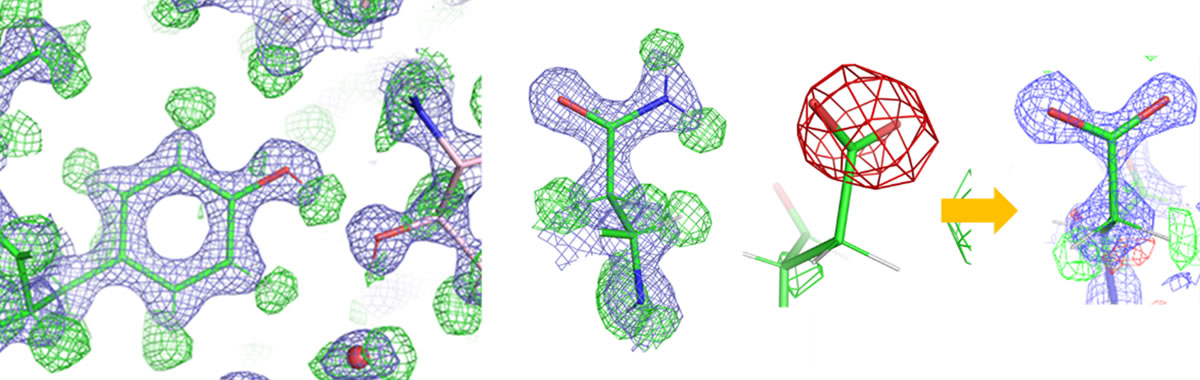
タンパク質中のアミノ酸の詳細構造(緑の網目は水素原子、赤の網目は負電荷に対応)
背景
クライオ電子顕微鏡を用いた単粒子解析は、タンパク質溶液を急速凍結した後、電子顕微鏡で撮影し、得られた2次元の分子像からコンピュータでその立体構造を再構成する技術です。試料の結晶化を必要とせず、生理的な環境下に近い水溶液中のタンパク質の詳細な立体構造を明らかにできます。タンパク質のような巨大で複雑な分子の結晶を作ることは難しいため、この技術は大きな注目を集めました。より詳細にタンパク質の構造を明らかにするため、世界中で技術競争が続けられています。研究チームは、これまで干渉性[5]の高い電子ビームを発生する国産クライオ電子顕微鏡[6]の利用技術の開発を進め、高い空間分解能を達成したほか、さまざまな成果を得てきました。
電子線の特徴は、原子の周りのクーロンポテンシャル[7](電荷分布)によって散乱されることです。これに対し、X線[8]は原子核の周りの電子によって散乱されます。この特性の違いにより、電子線では試料の電荷に関する感度が高いことが示されています。これまで、結晶性の無機試料に対しては回折法[9]を用いて、電荷分布が解析されてきました。最近では、タンパク質や有機化合物の微小結晶の電子回折から機能部位の荷電状態を調べたことも報告されています。結晶性の試料からは比較的高い品質のデータが得られ、高精度のデータが必要とされるこのような解析が可能となってきました。
一方、単粒子解析で扱う氷中のタンパク質から得られるクライオ電子顕微鏡像は、信号対雑音比[10]が他の手法に比べて劣ることから、電荷情報の取得は実現していませんでした。また、X線や電子線の散乱から得られる、最も軽い原子である水素原子の信号は非常に弱く、水素原子の可視化は困難です。
タンパク質中の水素原子や電荷、化学結合の極性などは、構造の安定化に重要な役割を果たすとともに、機能や性質に大きな影響を及ぼします。その分析には、通常の原子の立体配置に加え、これらの情報を取得することが必要です。
研究手法と成果
研究チームは、理研放射光科学研究センターの高性能国産クライオ電子顕微鏡(CRYO ARM 300)を用いた単粒子解析により、生体内で鉄を貯蔵する役割を持つアポフェリチンというタンパク質の構造を、1.19オングストローム(Å、1Åは100億分の1メートル)という世界最高の空間分解能で構造解析しました(図1)。
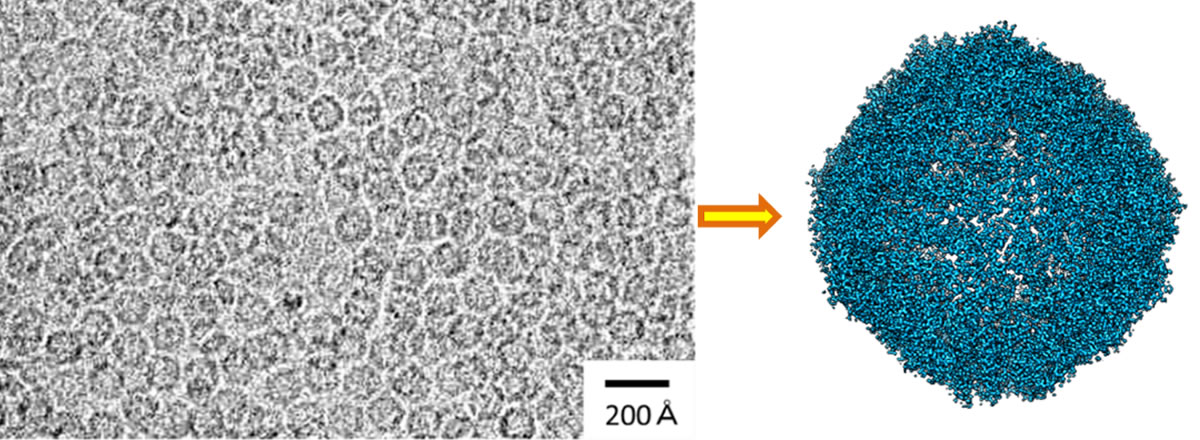
図1 球状のタンパク質アポフェリチンのクライオ電子顕微鏡解析
(左)クライオ電子顕微鏡写真。視野内に非常に多数の球状分子が写っている。
(右)単粒子解析による3次元再構成構造。
次に、この実験構造データから、構造に基づいて構築した原子配置のモデルのデータを引いた差(差マップ)を計算しました。このようにクライオ電子顕微鏡像やX線回折などの実験データと原子配置のモデルとの差を計算することは、モデルに含まれない基質、薬剤などのリガンド[11]や、水素原子などの弱い信号を検出するのに有効な手法です。水素原子を持たないモデルを用いると、現れた「正の差」は水素原子に相当し、実験データに由来すると考えられます。
この差マップから、タンパク質の安定部位におけるほとんどの水素原子が観察できました(図2)。例えば、チロシンというアミノ酸では、全ての水素原子が確認され、側鎖のベンゼン環の先端の水酸基(−OH)の水素原子が近くに存在する酸素原子と水素結合を形成していることも示されました(図2a)。
アミノ酸の中には類似した構造を持ち、実験データの構造からだけでは区別が難しいものがあります。しかし化学的性質は異なり、タンパク質の機能や構造形成に顕著な影響を及ぼすことがあります。アスパラギンとアスパラギン酸、グルタミンとグルタミン酸がその典型例で、それぞれ両者は側鎖末端のアミノ基(−NH2)の有無で区別されます。中性のpHで、アスパラギン酸とグルタミン酸は側鎖のカルボキシ基(−COOH)の水素原子が脱離します。今回の測定溶液がpH7.5であったことを反映して、得られた構造のアスパラギン酸とグルタミン酸のカルボキシ基には水素原子はありませんが(図2c、e)、アスパラギンとグルタミンのアミノ基には水素原子が二つ付いているのが確認されました(図2b、d)。これにより類似したアミノ酸でも明瞭に区別がつきます。
またX線結晶構造解析[8]では、アスパラギンとグルタミンのアミノ末端(−NH2)とオキソ末端(>C=O)の同定が特に難しいことが知られていますが、今回のクライオ電子顕微鏡で解析された構造では、水素原子の有無によってアミノ末端とオキソ末端が明確に識別されました(図2b、d)。中性のpHで、アスパラギン酸とグルタミン酸は側鎖のカルボキシ基の水素原子が脱離することで負の電荷(−δ)を持ちます(図2c、e)。
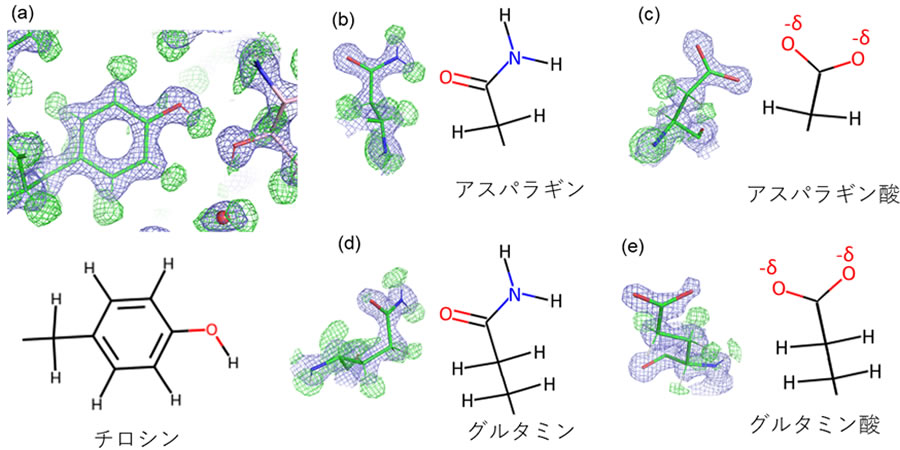
図2 アミノ酸の水素原子を含む高分解能構造の詳細
代表的なアミノ酸側鎖と対応する構造式を並べて表示した。緑の網目は水素原子(H)、青の網目はそれ以外の原子に相当する。
(a) ロシンの側鎖。全てのH、および側鎖のベンゼン環先端の−OHのHとその近くのOとの水素結合が確認できる。
(b) (d) アスパラギンとグルタミンの側鎖の−NH2および>C=Oが同定された。
(c) (e) アスパラギン酸とグルタミン酸の側鎖の−COOHは中性でHを失い、負の電荷を持つ。負電荷は末端の二つの酸素原子の周辺に非局在すると考えられ、−δと表す。
高分解能[4]の構造成分(分解能3.0~1.19Åもしくは2.5~1.19Å)を削除し、低分解能成分(分解能100~3.0Å)だけを用いて計算した差マップには、アスパラギン酸とグルタミン酸の側鎖に「負の差」が現れました(図3赤い網目)。
X線は、波長のごく短い光で電気的に中性であるのに対して、電子線は負の電荷を持っています。同じ原子でも電荷を持つものと中性のものでは、散乱のされ方が異なることから、電子線では試料の荷電状態をより高い感度で反映すると考えられます。実際、中性の原子と電荷を持った原子とでは、原子散乱因子[12]が低分解能領域で大きく異なり、負電荷を持つと電子の散乱因子は減少します(図4)。 そのため、実験データから中性の原子を仮定したモデルを引いた差マップでは負の差が現れると考えられます。一方、電子線照射により試料が損傷を受け構造が消失した場合も負の差となります。前述のアスパラギン酸とグルタミン酸で観測された負の差(図3赤い網目)が電荷に対応することを検証するため、実験データの低分解能領域(分解能100~3.0Å)の構造成分を削除したところ、負の差はほぼ消失しました(図3分解能2.5~1.19Åの構造)。このことは、中性の原子と電荷を持った原子の散乱因子が高分解能領域ではほぼ等しくなることと一致します(図4)。詳細な構造(高分解能成分)は電子線照射損傷をより受けやすいことが知られ、負の差が試料の損傷によるものであれば高分解能成分から計算した差マップに負の差が現れると考えられます。しかし、図3の観察では、反対に、負の差が消失したことから、観測された負の差は負の電荷を表すことが示されました。
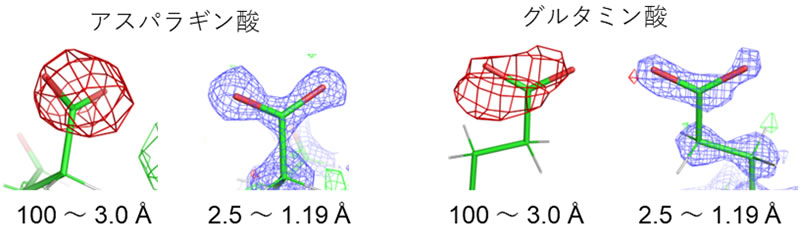
図3タンパク質中の負電荷の観測と検証
電子線の照射量の少ない最初に撮影した2フレームから低分解能(100~3.0Å)成分だけを用いて差マップを計算すると、赤の網目で示す負の差が現れる。全ての撮影フレームから高分解能(2.5~1.19Å)成分だけを用いて差マップを計算すると、負の差は消失する。
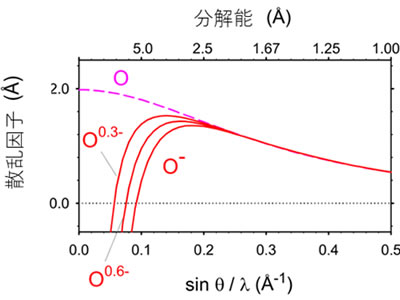
図4 酸素原子の電子に対する散乱因子
低分解能領域では、中性の酸素原子(O)と酸素イオン(O-)の電子の散乱因子は大きく異なり、負電荷を持つと散乱因子は減少する。一方、高分解能領域では両者の値はほぼ等しい。グラフに0.3(O0.3-)と0.6(O0.6-)の負の部分電荷を持つときの散乱因子を重ねて表示した。
観察結果をさらに補強する実験も行いました。クライオ電子顕微鏡像は、一つの視野に対して非常に短い間隔で連続的に画像を撮影します。電子線照射量が少ない撮影前半のデータのみを使って差マップを計算したところ、電子線照射損傷が増える後半のデータを含んだ場合と、負の差の現れ方にほとんど変化がないことが分かりました。また、負の電荷を与えたモデルにおけるシミュレーション結果とも一致しました。以上から、アスパラギン酸とグルタミン酸で観測された負の差が負電荷に相当することが確認されました。 化学結合の種類によって極性が異なるため、水素原子と結合相手の原子との距離は異なります。極性の高いアミノ基の窒素原子に結合した水素原子と炭素原子に結合した水素原子で、それぞれの結合相手からの距離を比較したところ、平均値に有意な差が見られました。これは、実測データから得られた構造が化学結合の種類や極性によって水素原子の位置を区別する精度を持つことを示しています。
今後の期待
本研究では、クライオ電子顕微鏡の単粒子解析を用いて、生理的な環境に近い水溶液中のタンパク質の分解能1.1Å台の構造から、ほとんどの水素原子とアミノ酸側鎖の負電荷を可視化しました。また、この構造が化学結合の種類や極性を区別する精度を持つことも示しました。
本成果はクライオ電子顕微鏡法の新たな可能性を示すものであり、今回開発した分析手法は化学結合の性質や電荷を解析する強力なツールへとさらなる進化が見込まれます。これらの精密分析技術を通して、生体分子の機能や特性のより深い理解が進み、生命科学の発展や創薬、医療への貢献が期待できます。
論文情報
“Measurement of charges and chemical bonding in a cryo-EM structure”
Saori Maki-Yonekura, Keisuke Kawakami, Kiyofumi Takaba, Tasuku Hamaguchi, Koji Yonekura
Communications Chemistry
DOI: 10.1038/s42004-023-00900-x
補足説明
[1] クライオ電子顕微鏡
タンパク質などの生体分子を水溶液中の生理的な環境に近い状態で、電子顕微鏡で観察するために開発された手法。まず、試料を含む溶液を液体エタン(約-170℃)中に落下させ急速凍結し、アモルファス(非晶質、ガラス状)な薄い氷に包埋する。これを液体窒素(-196℃)冷却下で、電子顕微鏡観察する。電子顕微鏡内の真空中で試料を氷中に保持でき、また、冷却することで電子線の照射による損傷を減らせる。
[2] 単粒子解析
電子顕微鏡で撮影した多数の生体分子の像から、その立体構造を決定する構造解析手法。クライオ電子顕微鏡の技術進歩により、結晶を作らなくても分子の詳細な構造が得られるようになったことから急速に普及した。この発展を受け、クライオ電子顕微鏡の基礎技術の開発に貢献した3名のパイオニアに2017年のノーベル化学賞が贈られた。
[3] 化学結合の極性
化学結合した原子の電荷分布に偏りがあること、あるいはその偏りのこと。偏りがない場合は非極性という。
[4] 空間分解能、分解能
どのくらい細かくものを「見る」ことができるかの指標。空間分解能の値が小さい(分解能が高い)ほど、物質をより精細に観測できる。原子の大きさは、1オングストローム(Å、1Åは100億分の1メートル)程度で、個々の原子の解像には1Å程度の空間分解能が必要である。
[5] 干渉性
波の位相の一致度を示す指標で、空間的干渉性と時間的干渉性がある。電子顕微鏡の発生する電子ビームは、空間的干渉性が高い。時間的干渉性は電子顕微鏡像の高分解能成分の減衰に寄与し、時間的干渉性が低いと高分解能成分は急速に下がる。冷陰極電界放射型の電子銃が発生するビームの時間的干渉性は高く、高分解能の特性に優れている。一方、この特性の単粒子解析での有効性は分かっておらず、国産の装置の登場以前には、冷陰極電界放射型電子銃を搭載したクライオ電子顕微鏡は存在しなかった。
[6] 国産クライオ電子顕微鏡
日本電子株式会社(JEOL)のCRYO ARM 300が初の国産クライオ電子顕微鏡であり、2018年に一号機が理研放射光科学研究センター(兵庫県)に導入された。冷陰極電界放射型の電子銃を搭載する世界初のクライオ電子顕微鏡装置であり、世界最高分解能の単粒子解析、光合成に関わる膜タンパク質複合体の詳細な構造解析、有機化合物やポリペプチドの電子線3次元結晶構造解析などの成果を上げてきた。
装置の詳細は下記を参照。
2019年5月21日プレスリリース「タンパク質やその複合体の高分解能・高精度解析に成功」
https://www.riken.jp/press/2019/20190521_1/index.html
[7] クーロンポテンシャル
原子や分子の電荷の分布で、電子の散乱現象からその情報が得られる。X線では電子密度が観測されるのに対して、電子線からはクーロンポテンシャルが観測される。
[8] X線、X線結晶構造解析
X線は波長の短い光で、物質の構造などを調べるのに利用される。X線結晶構造解析は、対象とする結晶にX線を照射して得られる回折データを解析することにより、結晶内部の原子の立体的な配置を調べる方法。タンパク質のX線結晶構造解析には、1Å程度の波長のX線が用いられる。
[9] 回折法
X線や電子線が結晶性の試料に散乱され、干渉して回折を示す現象を用いて分子の構造や並びを解析する手法。分子の並びを反映した規則的な回折点の並びなどの特徴的なパターンが観測される。
[10] 信号対雑音比
雑音(ノイズ)に対する信号(シグナル)の比。測定の精度を表す指標で、値が大きいほど測定の精度は高い。
[11] リガンド
タンパク質に特異的に結合する基質や薬剤などの化合物。
[12] 原子散乱因子
X線や電子線が原子にどのように散乱されるかを表す曲線。散乱角(空間分解能)に対する強度として表され、原子種によって異なる。X線の原子散乱因子は、中性と電荷を持つ原子でほとんど違いはないが、電子線の原子散乱因子は両者で大きく異なる。
研究チーム
理化学研究所 放射光科学研究センター
利用システム開発研究部門 SACLAビームライン基盤グループ
イメージング開発チーム
研究員 眞木さおり(マキ・サオリ)
(東北大学 多元物質科学研究所 客員教授)
利用技術開拓研究部門 生体機構研究グループ
グループディレクター 米倉功治 (ヨネクラ・コウジ)
(東北大学 多元物質科学研究所 教授)
研究員 川上恵典 (カワカミ・ケイスケ)
基礎科学特別研究員 高場圭章 (タカバ・キヨフミ)
研究員(研究当時) 濵口 祐 (ハマグチ・タスク)
(現 東北大学 多元物質科学研究所 准教授、理研 客員研究員)
研究支援
本研究は、科学技術振興機構(JST)未来社会創造事業探索加速型「微小結晶構造の自動・高精度電子線解析(研究代表者:米倉功治、JPMJMI20G5)」、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS)「高分解能単粒子解析、電子線結晶構造解析及びAI測定の高度化と支援(研究代表者:米倉功治、JP22ama121006)」、日本医療研究開発機構(AMED)医療研究開発革新基盤創成事業(CiCLE)などの助成を受けて行われました。
関連リンク
発表者・機関窓口
<発表者>
理化学研究所 放射光科学研究センター
利用システム開発研究部門 SACLAビームライン基盤グループ
イメージング開発チーム
研究員 眞木さおり(マキ・サオリ)
利用技術開拓研究部門 生体機構研究グループ
研究員 川上恵典 (カワカミ・ケイスケ)
グループディレクター 米倉功治 (ヨネクラ・コウジ)
(東北大学 多元物質科学研究所 教授)
基礎科学特別研究員 高場圭章 (タカバ・キヨフミ)
研究員(研究当時) 濵口 祐 (ハマグチ・タスク)

川上恵典、米倉功治、眞木さおり(左から)
<機関窓口>
理化学研究所 広報室 報道担当
Tel: 050-3495-0247
Email: ex-press[at]ml.riken.jp
東北大学 多元物質科学研究所 広報情報室
Tel: 022-217-5198
Email: press.tagen[at]grp.tohoku.ac.jp
科学技術振興機構 広報課
Tel: 03-5214-8404, Fax: 03-5214-8432
Email: jstkoho[at]jst.go.jp
<JST事業に関すること>
科学技術振興機構 未来創造研究開発推進部
小泉輝武(コイズミ・テルタケ)
Tel: 03-6272-4004, Fax: 03-6268-9412
Email: kaikaku_mirai[at]jst.go.jp
※上記の[at]は@に置き換えてください。




